БЕЛТЪЦИ – СТРОЕЖ, СВОЙСТВА И ФУНКЦИИ
Функции на белтъците
Белтъците заемат ключово място сред веществата, свързани с живота - или поне с този тип живот, който познаваме. Ако трябва да опишем с две думи химичната му основа, тя е следната: вода и соли за вътрешна среда, липиди за разграничаване на тази среда, нуклеинови киселини за запис и разчитане на наследствената информация, полизахариди за спомагателен "външен скелет" на клетката (и то не винаги) и белтъци за всичко останало.
Накратко, това "всичко останало" включва:
1. Механична функция. Белтъците изграждат нишки, които служат като опори на клетката и тъканите (цитоскелет, нуклеоскелет, извънклетъчен матрикс). Освен това пак чрез белтъци се осъществява активно движение на някои от тези нишки.
2. Катализа. Реакциите в организма се контролират чрез ензими (белтъци-катализатори).
3. Мембранен транспорт. В мембраните на клетката са "вградени" белтъци-преносители, които прехвърлят избрани молекули и йони през липидния двуслой. Така се определят химичният състав и електричните потенциали на клетката и всеки неин отдел.
4. Специфично разпознаване на дадена молекула, свързване с нея и съответна реакция. Например в клетъчната мембрана има белтъци-рецептори, които приемат сигнали отвън и така служат за клетъчни "сетива". Някои от въпросните сигнали също са белтъци, например белтъчните хормони. Дори самата ДНК, за да работи правилно, се нуждае от регулаторни белтъци, които се свързват с нея и определят кога даден ген ще се презаписва и кога – не.
5. Поддържане на вътрешната среда. Тук можем да споменем например хемоглобина.
Този списък не претендира за изчерпателност. Ясно е обаче, че белтъците са натоварени с разнообразна и често доста сложна работа. За да се справят с всички тези функции, белтъчните молекули трябва да имат наистина необикновен строеж.
Състав и общ строеж
Белтъците са полимери на алфа-аминокиселините. Това са съединения, в които към един и същ въглероден атом са присъединени аминогрупа и карбоксилна група. Общата им формула е следната:
H2N – CHR – COOH
Тук R е т. нар. радикал или странична верига – част от молекулата, по която отделните аминокиселини се отличават една от друга.
В изграждането на белтъците участват 20 вида алфа-аминокиселини. 19 от тях отговарят точно на горната формула, а пролинът – приблизително (той е иминокиселина). Всяка аминокиселина се означава с трибуквено съкращение, например глицинът е Gly. Освен това аминокиселините имат и общоприети еднобуквени означения, но те не са толкова популярни, тъй като е трудно да се запомни коя буква на коя аминокиселина съответства.
В организмите са открити още десетки аминокиселини, но те изпълняват други функции и не участват в състава на белтъците. Освен това човек без усилие може да измисли още поне стотина. Това поставя въпроса с какво са забележителни тези 20 аминокиселини, за да се използват в белтъците на всички известни ни организми. Отговорът е, че те се задават от гените чрез правило за съответствие, наречено генетичен код. Разбира се, може да се попита защо точно толкова и защо точно тези аминокиселини са били включени в генетичния код. Изборът на 20-те аминокиселини е толкова древно събитие, че едва ли ще бъде задоволително изяснен. Вероятно е имало и намеса на случайността. Веднъж разработен, механизмът за синтеза на белтъците е "сковал" състава им: дори и да са подходящи за изграждане на белтъците, нови аминокиселини не могат да се прибавят към списъка, защото няма лесен начин да се зададат от гените. Всъщност някои аминокиселинни остатъци в белтъка могат да се поизменят от ензими след транслацията. Например част от съдържащия се в колагена пролин впоследствие се окислява до хидроксипролин. Такива посттранслационни модификации обаче са доста тромав начин да се определя съставът на белтъка, а и с тях не може да се постигне всичко.
При 19 от 20-те аминокиселини централният въглероден атом е свързан с 4 различни заместителя. Изключение е глицинът, чийто радикал е водороден атом. Това значи, че всяка аминокиселина без глицина е представена от 2 оптични изомера. При синтезата на белтъците се използват само L-аминокиселини. Отново може да се попита защо. Ако се използваха и двата изомера, това вероятно би усложнило и объркало структурата, така че е разбираемо да се предпочете единият. D-изомерите поне от наша гледна точка не изглеждат по-лоши от L. Вероятно в ранната земна история L-аминокиселините са били предпочетени случайно. При химична синтеза двата изомера се получават в равни количества. Те могат да преминават един в друг (рацемизация), за щастие не много бързо. Затова във вкаменелостите освен L се откриват и D-аминокиселини, и то толкова повече, колкото по-старо и зле запазено е изкопаемото.
Белтъчната молекула се състои от една или няколко полипептидни вериги, които имат следния вид:
Н– (–NН–СНR–СО–)n –ОН
Вижда се, че аминокиселините са свързани помежду си с връзки между СО и NH. Този тип връзка, както и цялата група CO–NH, се нарича пептидна. В единия край има свободна (невключена в пептидна връзка) аминогрупа, а в другия - свободна карбоксилна група. Затова краищата се наричат съответно азотен (N–) и въглероден (С–).
Полипептидните вериги се получават чрез поликондензация на аминокиселините. Прибавянето на аминокиселина към синтезиращата се полипептидна верига може да се представи по следния начин:
–NH–CHRn–COOH + H2N–CHRn+1–COOH –> –NH–CHRn–CO–NH–CHRn+1–COOH + H2O
Всъщност реакцията, представена така, е възмутително опростяване. Във водната среда на клетката е изключено аминокиселините да тръгнат сами да поликондензират с отделяне на вода. В действителност образуването на пептидните връзки става по доста по-сложен начин, който ще се обсъжда в раздел Транслация.
От горното уравнение се вижда (и това отговаря на истината), че новата аминокиселина се свързва със своята аминогрупа към карбоксилната крайна група на пептида. Затова синтезата започва от азотния край – той е "началото" на веригата. Последен се синтезира въглеродният край, т.е. той е "краят".
Някои белтъци се свързват ковалентно с небелтъчна съставка, която е нужна за изпълнението на функциите им. Тя може да бъде олигозахариден остатък (такъв белтък се нарича гликопротеин), фосфатна група (съотв. фосфопротеин), метален йон (съотв. металопротеин) и др.
Равнища на организация
Дотук разглеждахме белтъците по принцип, без дори да става дума по какво един белтък се отличава от друг. По-долу ще се спрем на особеностите на белтъчната молекула, които са индивидуални за всеки белтък и са пригодени за неговата функция. За удобство разглеждаме строежа на белтъците като съчетание от 4 равнища на организация на белтъчната молекула, наричани накратко структури на белтъчната молекула.
Първична структура
Първото, на което трябва да се спрем, е дължината на полипептидните вериги. Броят на съставните аминокиселинни остатъци е точно определен за всяка полипептидна верига. Най-често е между 100 и 150, но доста варира при веригите на различните белтъци. Най-малките полипептиди, заслужаващи името белтъци, са дълги около 60 остатъка, а най-големите надхвърлят 1500. С други думи, отделните белтъци се различават по размерите и молекулната си маса над 20 пъти.
Следващото, което трябва да се посочи за веригата, е съставът й - какви са изграждащите я аминокиселинни остатъци. Ако погледнем формулите на аминокиселините ще видим до каква степен са различни. Радикалът може да бъде водороден атом, въглеводороден остатък (мастен или ароматен), да включва хидроксилна група, допълнителна аминогрупа или карбоксилна група, да съдържа сяра и т. н. Ако в състава на веригата преобладават аминокиселини с радикали, съдържащи хидроксилни и амидни групи, белтъкът ще бъде хидрофилен и незареден. Ако има много аминокиселини с неполярни остатъци, целият белтък ще бъде хидрофобен и почти неразтворим във вода. При повече аминокиселини с допълнителни аминогрупи белтъкът ще бъде основен, при повече допълнителни карбоксилни групи - кисел. Белтък, богат на глицин, ще има гъвкава молекула. Пролинът, обратно, сковава веригата, защото пръстенът му с фиксираните си ъгли не позволява свободно въртене. Структурата може да се "втвърди" и от присъствието на няколко цистеина, ако техните сулфхидрилни (–SH) групи две по две се окислят до дисулфидни мостове –S–S–. Ясно е, че съединенията, обединявани под името "белтъци", всъщност нямат практически никакви общи физични или химични свойства. Два случайно взети белтъка могат да бъдат толкова различни един от друг, колкото коприната - от сиренето (и на двете съставът е предимно белтъчен). Разбира се, скелетът на пептидната верига (–NН–CН–СО–) е еднакъв, но за да се стигне до него, трябва да се рови под "гъсталак" от уникални за дадения белтък радикали. По разнообразието на мономерите си белтъците рязко се различават от другите абсолютно необходими за живота полимери - нуклеиновите киселини. ДНК и РНК имат само по 4 вида мономери, които от химична гледна точка много си приличат. Не е учудващо, че в най-ранната ("химична") еволюция повечето функции са били поети от белтъците, а не от нуклеиновите киселини, макар че някои РНК със своите пластични и каталитични способности са достойни съперници на белтъците.
От значение е не само какви са съставните аминокиселинни остатъци, а и как са разположени. Например за да може един белтък да се включи в мембрана, той трябва не само да съдържа поне 20-ина аминокиселини с хидрофобни радикали, а и те да са разположени последователно. Полученият неполярен участък от веригата се настанява в липидния двуслой. Ако същите аминокиселини са разхвърляни равномерно из целия белтък, няма да свършат работа.
Броят, видът и подреждането на аминокиселинните остатъци в полипептидната верига се наричат първична структура или аминокиселинна последователност на белтъка. Тя се задава еднозначно от ДНК по механизъм, който ще се обсъжда по-късно.
Разработени са методи, позволяващи да се "разчете" първичната структура на всяка полипептидна верига, която си струва този труд. Установяването на първичната структура се нарича секвениране (от къснолат. sequentia – последователност). След като бъде намерена, първичната структура се представя във вид на текст, в който отделните аминокиселини са означени поред от азотния до въглеродния край.
Общи данни за пространствената структура
Колкото и да е важна, първичната структура сама по себе си не казва всичко за белтъка. Когато записваме аминокиселинната последователност на полипептидната верига, ние я опъваме като ред от текст. В действителност полипептидите са нагънати в пространството по начин, който в никакъв случай не е маловажен за функцията им.
Когато се разглежда пространствената структура на дадена молекула, използват се два термина - конфигурация и конформация. Конфигурацията е пространствена структура, основана на "фиксирани" химични връзки, които не могат да се въртят свободно. Когато в химията се говори за пространствена изомерия, обикновено се имат предвид конфигурации - две или повече точно определени структури, които преминават една в друга рядко и със значителен разход на енергия. В полипептидната верига такава изомерия е възможна само при пролиновите остатъци заради пръстенния им строеж.
Конформациите, обратно, са структури, които се получават чрез свободно въртене около прости връзки. Броят им е неограничен. Преходите от един вариант в друг са много чести и за тях е достатъчна енергията на топлинното движение на атомите. Ако можехме да видим такава молекула, очертанията й щяха да бъдат замъглени от непрекъснатите конформационни преходи.
В "скелета" на полипептидната верига (–NН–СН–СО–) всички връзки с изключение на пептидните са прости. По причини, които няма да разглеждаме тук, пептидните връзки донякъде се държат като двойни и съответно са във фиксирано положение. Но дори и след като ги извадим от сметката, в полипептида остават предостатъчно други връзки, позволяващи свободно въртене. Оттук можем да очакваме голямо разнообразие от форми на молекулата в рамките на дадена първична структура. В действителност обаче конформациите на полипептидната верига, макар и многобройни, не са особено разнообразни. Те представляват "вариации на една тема" – могат да се разглеждат като неголеми отклонения от една определена "средностатистическа" структура. Тази пространствена структура, от която белтъкът при нормални обстоятелства не се отклонява силно, се нарича нативна. Тя е най-изгодната от термодинамична гледна точка, т.е. полипептидната верига е най-бедна на свободна енергия, когато е в нативната конформация. За да се извади белтъкът от нативното състояние (процес, наречен денатурация), той трябва да получи енергия. Наистина всеки отделен конформационен преход изисква нищожно количество енергия, но промяната на нативната структура включва много преходи, така че сумарната енергия става значителна. Затова белтъкът е склонен да остава нативен.
Много други полимери също имат определена енергетично изгодна структура, но тя е винаги еднаква. Например всички вериги скорбяла се завиват спирално. Белтъците обаче са изключителни с това, че на всяка полипептидна верига съответства нейна собствена нативна структура. Причината е, че термодинамично изгодната конформация в крайна сметка се определя от първичната структура, а тя е твърде разнообразна.
За полипептида е желателно да се нагъне така, че разноименно заредените му радикали да се сближат. Освен това разтворителят (водата) влияе много силно. Заредените и полярните странични групи "се стремят" да се разположат на повърхността на нагънатия полипептид, за да могат да "общуват" с полярните водни молекули. За неполярните радикали, обратно, най-изгодно е да бъдат събрани във вътрешността на макромолекулата, така че да нямат допир с водата. Това е проява на т. нар. хидрофобни взаимодействия, които всъщност се дължат не на някакво привличане между неполярните странични вериги, а на това, че водата ги отблъсква (същите "сили" карат капките мазнина в супата да се сливат помежду си). Така нативната пространствена структура се поддържа от многобройни нековалентни връзки – йонни, водородни, Вандервалсови и хидрофобни. Към тях трябва да добавим и един тип ковалентни връзки – споменатите дисулфидни мостове. Как точно ще се нагъне полипептидът, за да може да осъществи възможно най-много такива взаимодействия, зависи от вида и мястото на участващите радикали, т.е. от първичната структура. (До голяма степен това обсъждане е валидно и за РНК.)
Вторична структура
Когато се разглежда пространствената структура на белтъците, следва да се започне с поведението на "скелета" на полипептидната верига. Поради своите силно полярни връзки пептидните групи са доста "общителни". Две пептидни групи могат да образуват водородна връзка, като водородният атом от едната се свърже с кислородния атом от другата:
> N – H :::: O = C <
В такива взаимодействия обикновено са въвлечени множество пептидни групи от една молекула. Това принуждава някои участъци от белтъка трайно да заемат дадена конформация, благоприятна за образуването на водородни връзки. Тя се получава, като някаква подходяща извивка се повтаря неколкократно по дължината на засегнатия участък. Такова закономерно периодично нагъване на полипептидната верига, основано на водородни връзки между пептидните групи, се нарича вторична структура.
Първото, което следва да се отбележи за вторичната структура, е, че участващите пептидни групи трябва да са на известно разстояние една от друга. Веригата не може да се огъне толкова рязко, че да позволи свързване на две съседни пептидни групи. Всъщност, ако вземем H-атома на произволна пептидна група, то най-близкият O-атом, с който той може удобно да образува водородна връзка, принадлежи на четвъртия аминокиселинен остатък (броено назад по веригата).
За да се осъществи такава връзка, участниците в нея трябва да се сближат чрез извиване на полипептидната верига (подобно на витата стълба между двата етажа на мезонет). Ако цяла поредица от аминокиселинни остатъци се свържат така по системата "всеки с четвъртия", получава се спирала, наречена алфа-спирала. Класически пример за алфа-спирала е молекулата на миоглобина, която можете да видите например на http://www.ncbi.nlm.nih.gov/books/bv.fcgi?call=bv.View..ShowSection&rid=cell.figgrp.359. Миоглобинът се съдържа в мускулните влакна и свързва кислород, който после се използва при работата им. Той е необичаен с това, че почти целият се състои от алфа-спирали. При повечето белтъци алфа-спиралите не заемат толкова голяма част от молекулата
Алфа-спиралата е много по-ъглеста от това, което обикновено си представяме под спирала. Не бива да се забравя, че в органичните молекули връзките сключват определени ъгли, така че дори и най-опънатата полипептидна верига ще бъде зигзаговидна. Когато този зигзаг се увие спирално, получава се начупена линия, подобна на старите открити реотани.
Алфа-спиралата не е единственият начин да се уредят водородни връзки между множество пептидни групи. Друг такъв начин е полипептидната верига да бъде опъната в даден свой участък, след това да завие на 180 градуса и отново да се опъне. Получават се две успоредни сближени отсечки, между които могат да се образуват много водородни връзки. Ако веригата се извие още веднъж, може да се оформи трети такъв участък, който да се свърже с втория и т. н. Отсечките се разполагат в една равнина, ако не броим това, че зигзагът на полипептидната верига придава на плоскостта леко "гофриран" вид. Заради своята двуизмерност получената структура се нарича бета-лист или бета-слой. Тя е по-лесна за разбиране от алфа-спиралата, понеже може удобно да се нарисува на лист хартия. (За да стане моделът още по-точен, накрая листът може да се нагъне на хармоника.) От по-известните белтъци бета-листове имат антителата (имуноглобулините).
Бета-листът има и друг вариант: веригата между отделните отсечки вместо на 180 градуса да завива на 360 градуса, описвайки широка дъга. Този "паралелен" бета-лист се среща по-рядко от "антипаралелния" и дори на тази опростена рисунка изглежда прекалено нагласен.
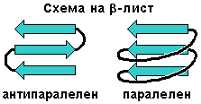
И така, макар че скелетът на полипептидната верига е еднотипен, имаме два основни типа вторична структура. Следва да се попита кога се образува алфа-спирала, кога – бета-лист и кога – неправилно нагънат участък от полипептидната верига без определена вторична структура. След като е била изучена първичната и пространствената структура на доста белтъци, въпросът се е поизяснил. Макар че не участват в самата вторична структура, радикалите силно влияят върху нея. Някои съчетания от аминокиселини са склонни да се нагъват в алфа-спирала, други – в бета-лист, а трети не допускат каквато и да е вторична структура.
Третична структура
Алфа-спиралите и бета-листовете не изчерпват пространствения строеж на белтъчната молекула. Участъците от полипептида, които са извън вторичната структура, по правило са гъвкави. Те изпълняват в полипептидната верига ролята на стави, като позволяват различни взаимни положения на спиралите и листовете. В нативно състояние тези "шарнирни" участъци не са опънати, а не са и случайно усукани, макар че обикновено имат такъв вид. В действителност те се извиват така, че да позволят на радикалите да образуват възможно най-много връзки помежду си и с разтворителя. Това допълнително нагъване на полипептидната верига, основано на взаимодействия на радикалите, се нарича третична структура. За много белтъци тя е "окончателната" структура, т.е. видът, в който те се намират в организма и функционират.
Подобно на вторичната структура третичната се крепи от връзки между аминокиселини, отдалечени една от друга по веригата. Обикновено разстоянието тук е още по-голямо, отколкото при вторичната структура. Участващите аминокиселини могат да бъдат както от "шарнирните" участъци, така и от алфа-спиралите и бета-листовете, понеже вторичната структура не ангажира радикалите и ги оставя свободни за други взаимодействия.
Докато първичната структура се поддържа само от пептидни връзки, а вторичната - от водородни, за третичната трябва да повторим целия даден по-горе списък: тя включва дисулфидни, йонни, водородни, Вандервалсови и хидрофобни връзки между радикалите (последните, строго погледнато, всъщност отразяват взаимодействието с водата). Дисулфидните мостове заслужават две думи за пояснение. Измежду посочените връзки само те са ковалентни и може да се помисли, че имат ключово значение. В действителност те са спомагателни. За да се образуват, е необходимо предварително сближаване на двата участващи цистеина. Това значи, че веригата трябва за сметка на нековалентни взаимодействия да се огъне горе-долу до окончателната си форма, така че дисулфидните мостове само да я "закопчаят". Освен това само секретираните и повърхностните белтъци могат да имат дисулфидни мостове. В цитозола обстановката е твърде редукционна, за да позволи образуването им. (Когато при изследване на белтъка е необходимо да се разрушат дисулфидните му връзки, използва се именно тяхната неустойчивост спрямо редуктори – добавя се такова вещество и мостовете се разпадат до сулфхидрилни групи.)
Третичната структура на по-малките белтъци обикновено се свежда до нагъване, сближаващо няколкото им алфа-спирали или/и бета-листа в кълбо. То е доста плътно – във вътрешността му няма място за водни молекули. По-дългите полипептидни вериги често се нагъват така, че да се получат две или повече такива кълба, свързани с къси разгънати участъци. Всяко топчесто образувание от описания тип се нарича домен (от англ. domain – владение, област). Всъщност доменът може да бъде не само част от белтъчна молекула, а и цялостна молекула, както стана дума по-горе. Домените обикновено включват от 50 до 350 аминокиселини.
Когато веригата включва два или повече домена, те са обособени не само структурно, а и функционално. С други думи, различните домени на един белтък вършат различна работа. Нормално те действат съгласувано, но ако отделим един домен от другите, често той успява да осъществи функцията си и в това необичайно самотно състояние. Опитът може да се проведе било като синтезираме непълен белтък, включващ само въпросния домен, било като вземем цялостния белтък и го нарежем с протеаза. (Протеазите атакуват най-напред опънатите и гъвкави участъци от полипептидната верига, каквито са връзките между домените.)
Понякога отделни домени на различни белтъци си приличат по своето нагъване в пространството. Такъв тип третична структура, който се открива в цяла поредица от белтъци, се нарича белтъчен мотив. Всеки мотив е съобразен с изпълнението на дадена функция, което всъщност е и причината за неговата популярност.
Четвъртична структура
Както стана дума по-горе, много белтъци функционират в третичната си структура. Не са малко обаче и белтъците, които, за да могат да вършат работата си, трябва да минат през още едно равнище на организация, а именно да се "сглобят" от две или повече полипептидни вериги (субединици). Свързването на отделни полипептиди в комплекс, който функционира като едно цяло, се нарича четвъртична структура. По-горе мъгляво стана дума, че белтъците се състоят от полипептидни вериги; тук вече можем да кажем, че под белтъци разбираме полипептидните вериги и техните четвъртични комплекси.
Субединиците се свързват помежду си не случайно, а специфично. Те се "разпознават" помежду си благодарение на това, че някои техни повърхности имат пространствено сродство една към друга. Понякога субединиците са еднакви, понякога - различни. Някои полипептидни вериги могат да участват в четвъртична структура с различни "партньори" според случая.
Четвъртичната структура се основава на същите взаимодействия между радикалите като третичната: йонни, водородни, Вандервалсови, хидрофобни, а при белтъците извън цитоплазмата – и дисулфидни мостове.
Най-известният пример за четвъртична структура е хемоглобинът. Той е комплекс от 4 субединици, които са еднакви две по две. Всяка от тях прилича на миоглобина, който "складира" кислород в мускулите и се състои само от една полипептидна верига. Миоглобинът не се нуждае от четвъртична структура, но тя е подходяща за функцията на хемоглобина: ефективното свързване на кислорода в белите дробове и освобождаването му в тъканите се дължи на леки размествания на четирите субединици една спрямо друга.
Освен това почти всички ензими, които се регулират алостерично, имат четвъртична структура. Активният център се носи от една субединица, наречена каталитична, а алостеричният – от друга, наречена регулаторна.
Когато в четвъртична структура са обединени две или няколко точно определени субединици, често ги наричаме общо "молекула" независимо дали са свързани с дисулфидни или само със слаби връзки. От строго химична гледна точка не е редно да говорим например за "молекула хемоглобин", понеже хемоглобинът е надмолекулен комплекс - между четирите му субединици няма нито една ковалентна връзка. Не е необходимо обаче човек да се отнася толкова педантично към термините. (Между другото е трудно да се намерят два учебника, които напълно да съвпадат по своите схващания за равнищата на организация на белтъка.)
Освен малки четвъртични комплекси като гореспоменатите има и големи, съставени от значителен и обикновено неопределен брой субединици (десетки, стотици или хиляди). Примери за такива белтъчни комплекси са нишките на цитоскелета и капсидите на вирусите.

 Ако предлагате частни уроци, може да рекламирате услугите си напълно безплатно!
Ако предлагате частни уроци, може да рекламирате услугите си напълно безплатно!




Коментари