БЕЛТЪЦИ – МЕТОДИ ЗА ИЗСЛЕДВАНЕ
Всички твърдения и схеми за белтъците,
дадени в предходния раздел, са изводи, които се основават на внушителни опитни
данни. За да се спази духът на научното мислене, би трябвало човек да поиска да
се запознае с тези данни, преди да повярва в каквото и да било. На практика
обаче опитите и техните "сурови" резултати са прекалено обемисти, за да се
добавят към и без това сгъстените курсове, а според повечето студенти са и
прекалено досадни. Като компромис може бегло да се подметне какви методи се
използват в дадената научна област. Повечето от посочените по-долу методи
всъщност се използват не само за белтъци, а и за други съединения.
Наблюдение на белтъците в естественото им място – цитохимия и
имуноцитохимия
Често е необходимо да знаем къде точно в организма се
намира даден белтък – в кой орган, в кои клетки (или в междуклетъчното вещество)
и в коя част от клетките. Разработени са група методи, чрез които в микроскопски
препарат може да се види ясно къде присъства даден белтък. Те се обединяват под
името цитохимия (хистохимия).
Някои бои оцветяват дадена група белтъци
силно, а останалите белтъци и другите съставки на тъканта – слабо или
незабележимо. Когато това свойство е известно, то може да се използва за
визуализиране на въпросната група белтъци, т.е. да ги направим видими.
Ако търсеният от нас белтък е ензим, можем да го открием, като направим
видима катализираната от него реакция (ензимна цитохимия). За целта добавяме към
клетките такъв субстрат, който да се преработи от ензима до цветен продукт. Ако
ензимът е налице в някои части от нашия препарат, след това под микроскоп ще ги
видим обагрени в цвета на продукта. Цитохимично откриване на белтъци може да се
осъществява както на светлинно-микроскопско, така и на електронно-микроскопско
равнище.
Повечето цитохимични методи имат сравнително слаба
специфичност. Например с цветна реакция за пероксидаза се установяват десетки
различни белтъци, които имат пероксидазна ензимна активност. За някои белтъци
обаче са известни реактиви, които се свързват с тях специфично. Такъв реактив,
който добавяме към изследвания препарат, за да се свърже специфично с някаква
негова съставка, се нарича сонда.
Обикновено сондата сама по себе си не
е лесно забележима. Всъщност да очакваме от един и същ реактив и да свързва
специфично нашия белтък, и да е ярко оцветен, значи да искаме твърде много от
живота. Безцветната сонда се прави забележима, като към нейната молекула се
прикрепи друга, лесно видима молекула – т. нар. белег. Това действие се нарича
белязване на сондата. Белегът може да бъде боя, радиоактивен изотоп, ензим,
катализиращ цветна реакция, и др.
Към клетките е
добавен фалоидин, свързан с флуоресцентна боя. Флуоресцентните бои
(флуорохромите) при осветяване с ултравиолетова лампа отделят видима светлина,
което може да се наблюдава с флуоресцентен микроскоп и да се снима.
Доколкото природата не е подчинена на удобството на изследователите,
естествени специфични сонди като фалоидина са известни за много малко белтъци.
Такива сонди обаче могат при нужда да се получат изкуствено. За целта се
използва способността на имунната система да реагира срещу чужди белтъци. Ако
разполагаме с интересуващия ни белтък в чист вид, можем да го инжектираме в
тялото на бозайник (или друго гръбначно животно). Белтъкът ще влезе в ролята на
антиген, т.е. ще предизвика имунната система на животното да му противодейства.
След известно време тя ще произведе антитела – белтъци, които се свързват с
нашия белтък (антигена) специфично. Те се съдържат в серума и могат удобно да се
получат оттам. Антителата са отлични сонди. Специфичното откриване на белтъци с
помощта на антитела се отделя от останалите цитохимични методи под името
имуноцитохимия (имунохистохимия).
Антитялото може да бъде свързано
(конюгирано) с боя или друг белег. Когато антитялото ни е белязано по този
начин, казваме, че използваме пряк имуноцитохимичен метод.
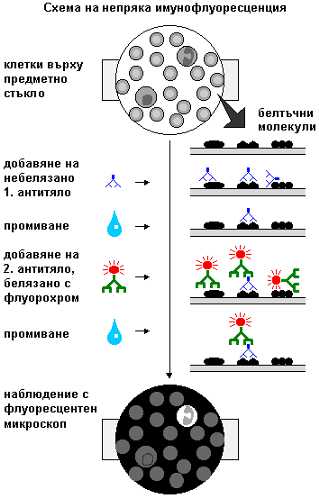
На схемата
долу е показана пряка имунофлуоресценция – вид имуноцитохимична реакция, при
която антитялото срещу изследвания белтък е белязано с флуорохром. Първо се
приготвя препарат от интересуващата ни тъкан, като клетки от нея се разполагат
върху предметно стъкло и се фиксират. След това върху стъклото се накапва
разтвор на белязаното антитяло. Изчаква се известно време антитялото да намери
своя антиген в препарата. После стъклото се промива, за да се отстрани излишното
антитяло (т.е. което не е реагирало с прицелния белтък). Вече препаратът е готов
за наблюдение – ако се сложи под флуоресцентен микроскоп, участъците, където се
намира търсеният белтък, ще светят.

Обикновено обаче действията са малко по-усложнени. Антитялото срещу нашия белтък (наречено първо антитяло) се използва небелязано. След промиването накапваме върху стъклото разтвор на друго антитяло, за което антиген е 1. антитяло, т.е. имаме антитяло срещу антитяло (по-точно срещу имуноглобулин). Това антитяло се нарича второ и е белязано. Оставяме препарата с него за известно време, промиваме отново и наблюдаваме.
Снимката показва имунофлуоресценция на миши сперматозоиди, обработени с 1. антитяло срещу тубулин и 2. антитяло, белязано със зелен флуорохром. Вижда се, че светят опашките на клетките.

Основното
предимство на двустъпалната реакция е, че няма нужда антителата да се бележат в
самата лаборатория. Белязването е досадно и всеки би го избягнал, ако е
възможно. Белязаните 2. антитела (за разлика от повечето 1. антитела) са
търговски достъпни. Така, ако получаваме 1. антитяло от заек, можем да поръчаме
козе антитяло срещу заешки имуноглобулини, конюгирано с флуорохром. Това 2.
антитяло може да се използва не само за сегашното ни 1. антитяло, а и за всяко
друго 1. антитяло, което е от заек и с което бихме могли да работим в бъдеще.
Разбира се, съвсем не е задължително белегът да е флуорохром. Често 2.
антитяло се конюгира с ензим, който катализира цветна реакция. (Тази
разновидност на имуноцитохимията не бива да се бърка с ензимната цитохимия, при
която се търси ендогенна ензимна активност в самия препарат.) Когато
изследването е на електронно-микроскопско равнище, предпочитаният белег са
златни гранули с колоидни размери.
Получаване (изолиране) на белтъци
Общи бележки
Белтъците
съставят по-голямата част от сухото вещество на клетката, а в животинския
организъм – и от сухото междуклетъчно вещество. За много малко цели обаче (освен
за храна) човек се нуждае просто от "белтъци". Поради разнообразието на
белтъците разумният подход е един определен белтък да се получи пречистен поне
до известна степен. Ето защо, докато под "получаване на ДНК" до голяма степен се
разбира отделяне на ДНК от белтъците, "получаване на белтък" значи най-вече
отделянето му от другите белтъци.
При получаването и изследването на
белтъци е важно молекулите им да се запазят възможно най-добре. Основните
опасности са денатурацията и протеолизата (разграждането от ензими – протеази,
които хидролизират пептидните връзки). И двата процеса в известна степен
протичат и в организма, но силно се ускоряват, когато извадим белтъците от
естествената им среда. За да се предпазят белтъците, с тях трябва, ако е
възможно, да се работи бързо и на студено – в хладилна камера при 4 градуса или
на ледена баня. Ниската температура забавя както денатурацията, така и
протеолизата. Освен това в разтворите се добавят инхибитори на протеазите.
Съхраняването на белтъци за кратко време става в хладилник при 4 градуса, а за
по-дълго време – в камера при –20 градуса. Трябва да се избягва многократното
замразяване и размразяване, понеже и то уврежда белтъците.
Обичайният
вид на белтъците, когато се работи с тях, е да са разтворени. Разтворителят е
вода, в която има соли и някакви буферни съставки. Най-често осмотичното
налягане е като на физиологичния разтвор, а киселинността е близка до
неутралната. В чиста вода белтъците по правило не се разтварят добре и не
проявяват активността си в пълна степен.
Повечето белтъци и в организма
са в разтворено състояние. Някои образуват нишковидни агрегати (например
колагенът и цитоскелетните белтъци) и изискват специални условия, за да преминат
в разтвор. Мембранните белтъци се разтварят във водна среда само ако към нея се
добави детергент (повърхностно-активно вещество).
Фракционно центрофугиране
Когато се
получава даден белтък, се използват данните за естественото му място. Трябва да
вземем тъкан, за която знаем или предполагаме, че го съдържа. Ако тъканта е
суспензионна (напр. кръв), отделяме клетките от междуклетъчното вещество и
работим само с една от двете фракции. Например албумин ще получим от серума, а
хемоглобин – от масата кръвни клетки.
Отделянето на клетките се основава
на това, че плътността им е малко по-висока от тази на околната течност. Ако
имаме съд със суспензия от клетки и го оставим на спокойствие, те след известно
време ще се утаят на дъното. Доколкото това "известно време" е сравнително
дълго, ако се разчита само на действието на тежестта, процесът се ускорява, като
съдът със суспензията се постави в центрофуга. Въртенето създава
центростремително ускорение, което се определя от броя обороти за единица време
и от радиуса. То може многократно да надхвърли земното ускорение и под
действието на получената силна изкуствена "тежест" клетките ще се утаят бързо.
Ако в дадена методика пише например: "Центрофугирайте за 5 min при 1000 g", това
означава, че трябва да центрофугираме при такива обороти, че да получим
центростремително ускорение, надхвърлящо земното 1000 пъти. За утаяване на
клетки обикновено се използват 500 до 1500 g, което се приема за нискооборотно
(!) центрофугиране.
Ако белтъкът е съставка на даден тип органели,
понякога е уместно да се изолират тези органели и да се работи само с тях.
Клетките се разрушават (хомогенизират) механично. Полученият хомогенат се
подлага на центрофугиране при такива условия, че да се получи фракция, състояща
се предимно от желаните органели.
Схема на фракционно центрофугиране
(опростено по Марков, 1984, и Alberts et al., 1994). Микрозоми се наричат
мехурчетата, получени след разрушаване на ендоплазмената мрежа.

Например, ако
търсеният белтък е митохондриален, първо трябва да центрофугираме при 1000 g за
10 min. Ядрата и отделните оцелели клетки ще се утаят. Нашият белтък ще остане в
надутайката. Прехвърляме я в чиста епруветка и центрофугираме при "средни"
обороти (20000 g) за 20 min. Получаваме утайка, която съдържа митохондриите, а
също лизозомите и пероксизомите. Отстраняваме надутайката, съдържаща цитозола,
рибозомите и останките от ендоплазмената мрежа, и този път работим с утайката.
Съвременните т. нар. ултрацентрофуги позволяват високооборотно
центрофугиране (над 200000 g). При това се утаяват не само макромолекулни
комплекси като вирусите и рибозомите, а и много отделни макромолекули.
Скоростта, с която се утаява дадена частичка, зависи от големината и формата й и
се изразява с коефициент на седиментация, означаван с S (на името на пионера на
центрофугирането Сведберг).
При друг вариант на ултрацентрофугирането
частичките се разделят не по размери, а по плътност. За целта нашата проба
внимателно се надслоява върху предварително подготвен в центрофужната епруветка
плътностен градиент. Това е разтвор (най-често на захароза), чиято концентрация
се увеличава от повърхността към дъното. При центрофугирането клетъчните
компоненти се смъкват по градиента, докато не достигнат участък, в който
плътността на разтвора е равна на тяхната собствена. След това епруветката се
пробива и течността от различните нива се събира в отделни съдчета.
Фракционно утаяване чрез изсолване
Когато към белтъчен разтвор се добави сол до сравнително висока концентрация,
нейните йони отнемат хидратната обвивка на белтъците и предизвикват утаяването
им. При това белтъците не губят нативността си и могат да се разтворят отново, а
солта при нужда да се отстрани (например чрез диализа). Различните белтъци се
утаяват при различна солева концентрация и това може да се използва за разделяне
на белтъчни смеси. "Утаимостта" на даден белтък е в права зависимост от
молекулната му маса и се влияе от формата на молекулата.
Най-често
използваната сол е амониевият сулфат. Предизвиканото от него утаяване е
възпроизводимо и не уврежда белтъчните молекули.
Хроматография
Хроматографията
обединява група методи за разделяне на смеси от вещества. Общото между тях е, че
съставките се разделят благодарение на различното си сродство към някаква
неподвижна повърхност, върху която се прокарва сместа, носена от движеща се
течност. Името хроматография идва оттам, че едно от първите й приложения (от
Цвет през 1906) е било за разделяне на цветни вещества – фотосинтетични
багрила.
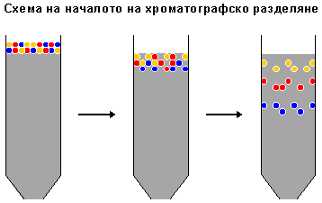
За да бъде неподвижната повърхност по-голяма, обикновено тя се
оформя във вид на дребни зърна, които се насипват в колона. Между тях се налива
течност. Сместа, която ще се разделя, се нанася на върха на колоната. Течността
се оставя да капе, като отгоре се долива още, за да носи белтъците надолу (иначе
те могат да заседнат в колоната или тя да изсъхне и да се увреди). Доливаната
течност се нарича елуент, а прокарването на сместа през колоната с нейна помощ –
елуиране. Поради нееднаквото си взаимодействие с повърхността на гранулите
отделните съставки се движат през колоната с различна скорост и я напускат по
различно време. Ако изтичащата от колоната течност се събира на малки порции
(фракции), компонентите на изходната смес ще се намират в някои фракции в чист
вид.
От многото видове
хроматография само някои се използват за разделяне на белтъци:
Разпределителна хроматография – гранулите се състоят от инертен носител,
върху който е адсорбиран тънък слой течност. Веществата се разделят според
относителната си разтворимост в подвижната и неподвижната течна фаза. За белтъци
най-често се използва разновидност на разпределителната хроматография, основана
на хидрофобни взаимодействия. Неподвижната течна фаза се състои от прикрепени
алкилови или арилови остатъци, които стърчат от носителя. Белтъците се разделят
според наличието на хидрофобни участъци в молекулата си.
Йонообменна
хроматография – в колоната има гранули от йонообменник. Това е полимер, който
съдържа ковалентно свързани йонни групи. При едни йонообменници те са
положително заредени, а при други – отрицателно; видът на йонообменника се
подбира според конкретния случай. Движейки се по колоната, белтъците
взаимодействат с йонните групи и така се разделят според заряда си.
Гелна (молекулно-ситова) хроматография – в колоната има зърна от порест
гел, чиито каналчета са с определен диаметър. Веществата се разделят според
големината на молекулите, т.е. според молекулната маса. Твърде големите молекули
не могат да влязат в зърната на гела и минават покрай тях, а по-малките навлизат
в порите и се задържат в гела известно време. Затова по-големите молекули се
движат в колоната по най-късия път и я напускат бързо, а по-малките се елуират
по-бавно. Гелът се произвежда в редица разновидности – с по-тесни или по-широки
каналчета, като диаметърът им се посочва от производителя. Така можем да изберем
гел, който да "прихваща" най-добре именно молекули с масата на търсения от нас
белтък (каквато и да е тя). Колоните за молекулноситова хроматография могат да
се използват и за пречистване на белтъци от нискомолекулни примеси.
Афинитетна хроматография – в колоната към носител е прикрепена молекула,
към която една от съставките на сместа има специфично пространствено сродство
(например антиген – антитяло, хормон – рецептор, ензим – субстратен аналог; защо
не е подходящо да се използва самият субстрат?). Първо се пуска пробата и се
елуират всички белтъци от сместа, които нямат сродство към прикрепената
специфична молекула. Само желаният от нас белтък, който има такова сродство,
остава свързан вътре в колоната. После условията се променят така, че
пространственото сродство да се изгуби (например се променя рН). "Нашият" белтък
се откъсва от колоната и може да се елуира оттам.
Схема на механизма на
разделяне при три вида хроматография. Частиците, които не взаимодействат с
неподвижната фаза, се движат по-бързо (означено със стрелки).
 Електрофореза
Електрофореза
Електрофореза
наричаме движението на заредени колоидни частици в електрично поле. Доколкото
различните частици се движат с различна скорост, по този начин могат да се
разделят смеси от белтъци и други макромолекули.
Електрофорезата се
извършва в носител – гел, за да се забави движението на молекулите. После
резултатът може да се вземе в ръце и да се разгледа спокойно, което не би било
възможно, ако електрофорезата протичаше свободно в разтвор. За белтъци се
използва полиакриламиден гел.
Белтъчната смес се нанася в началото на
гела и се включва постоянно напрежение. Посоката му се задава според заряда на
белтъците (на схемата те се движат към анода). В хода на електрофорезата
белтъчната смес се разслоява на отделни напречни ивици, които напредват през
гела с различна скорост. Токът се спира, когато най-бързите молекули на челна
позиция доближат края на гела. По същото време най-бавните едва ще са се
отместили от началото. Ако знаем коя точно ивица отговаря на "нашия" белтък,
можем да я изрежем от останалата част от гела и да извлечем белтъка.

Скоростта, с
която се движи дадена макромолекула, се определя от нейната електрофоретична
подвижност. Това е коефициент, аналогичен на коефициента на седиментация при
центрофугирането и зависим от заряда и масата на молекулата. Колкото е по-голям
зарядът (стига да е с нужния знак), толкова по-голяма е електрофоретичната
подвижност. Зависимостта на подвижността от молекулната маса обаче е обратна:
колкото по-голяма е молекулата, толкова по-силно съпротивление среща при
движението си през гела. Затова на рисунката най-късите полипептидни вериги са
най-отпред. (Съпротивлението, а оттам и подвижността, донякъде се влияе и от
формата на молекулата, но тази зависимост е по-слаба и тук ще я пренебрегнем.)
Тълкуването на резултата от електрофорезата е по-сложно при белтъците,
отколкото при другите макромолекули. Причината е, че полипептидните вериги нямат
"стандартен" заряд на единица дължина. Те получават заряда си от радикалите на
аминокиселините, които могат да бъдат както (+), така и (–) натоварени и не са
правилно подредени. Затова зарядът зависи от първичната структура, но не се
определя от молекулната маса; зарядът и масата са две независими променливи. В
зората на белтъчната електрофореза е било известно, че белтъците се разделят в
гела според заряда и масата си, но за коя да е отделна ивица не се е знаело нито
едно от двете.
Днес е възможно белтъчната електрофореза в гел да се
проведе така, че белтъците да се разделят само според молекулната си маса или
само според заряда си. Първият метод е по-лесен и се използва по-често, затова
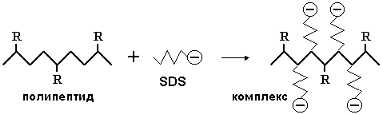
ще започнем с него. "Номерът" е, че на белтъците преди електрофорезата се
придава допълнителен "дозиран" (–) заряд. За целта към тях се прибавя разтвор на
детергента натриев додецилсулфат. По-долу ще го означаваме с SDS (съкр. от англ.
sodium dodecyl sulfate). Както личи и от името му, той има следната формула:
CH3 – (CH2)11 – OSO3Na
SDS се свързва с полипептидната верига
чрез хидрофобни взаимодействия:
Така
полипептидната верига получава допълнителен заряд пропорционално на своята
дължина (съответно на молекулната маса). Собственият й заряд вече не влияе
забележимо, защото е много по-слаб от допълнителния. Освен това SDS денатурира
молекулата и й придава еднотипна конформация, с което изчезва и влиянието на
нативната й форма.
Сега вече пробите могат да се накапят в стартове
близо до катода, за да тръгнат през гела към анода. След тази т. нар.
SDS-електрофореза белтъците с най-малка молекулна маса се оказват близо до края
на гела, а тези с най-голяма – близо до стартовете.
Резултат от
SDS-електрофореза. Пробите са се движили отгоре надолу. След електрофорезата
белтъчните ивици са оцветени. Виждат се общо 5 старта: М – маркери (белтъци с
известна молекулна маса, които се слагат за сравнение); 1 – нефракциониран
белтъчен препарат от плъши инсулин-произвеждащи клетки; 2, 3 и 4 – фракции от
същия препарат, утаени съответно с 40%, 60% и 100% наситен амониев сулфат;
числата вляво са молекулните маси на маркерите.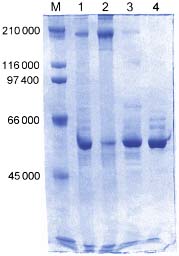
Разделянето на
белтъците по заряд се основава на това, че зарядът на белтъчната молекула зависи
от киселинността (рН) на средата. Радикалите на няколко аминокиселини във воден
разтвор могат да претърпят електролитна дисоциация и да получат заряд. Дали
обаче наистина те ще носят заряд, зависи и от йоните в средата. (Следва да си
припомним хидролизата на солите.) Ако средата е кисела, поради изобилието на Н+
повечето аминогрупи ще бъдат заредени (ще имат вида -NН3+), а повечето
карбоксилни групи ще загубят заряда си (ще добият вида -СООН). Белтъкът като
цяло ще бъде зареден по-положително, отколкото в неутрална среда. Основната
среда, обратно, отнема от белтъка протони и прави аминогрупите незаредени
(-NН2), карбоксилните групи – заредени (-СОО–), а цялата молекула –
по-отрицателно натоварена, отколкото в неутрална среда. Ето защо всеки белтък
при твърде алкално рН е зареден отрицателно, при твърде кисело рН – положително,
а някъде по средата има една стойност на рН, при която белтъкът няма заряд и
която се нарича негова изоелектрична точка. Тя е различна, защото зависи от
първичната структура на белтъците (т.е. от относителния дял на основни и кисели
аминокиселини), и е свързана със заряда, който белтъкът има в неутрална среда.
За да се разделят белтъците по заряд, в гела с помощта на специални
буфери се създава градиент на рН. След това при електрофорезата всеки белтък от
сместа се движи, докато не достигне мястото, където рН съвпада с изоелектричната
му точка. Там губи заряда си, с което се избавя от принудата на електричното
поле и престава да се движи. След известно време всички белтъци от изходната
смес се оказват подредени в гела по изоелектрични точки. Тази електрофореза се
нарича изоелектрично фокусиране и е аналогична на центрофугирането в плътностен
градиент.
За най-добро разделяне на белтъчна смес понякога
изоелектричното фокусиране и SDS-електрофорезата се обединяват в т. нар.
двумерна електрофореза. Първо се провежда изоелектричното фокусиране в гел,
излят в тръбичка. После гелното цилиндърче се прилепя до една от страните на
плочковиден гел с SDS и се включва електрично поле, перпендикулярно на
предишното. Така в едното направление белтъците са разпределени само според
заряда си, а в другото – само според молекулните си маси.
Снимка на гел, в който белтъци са разделени чрез двумерна електрофореза, можете да видите на тази снимка по долу:

Изследване на
белтъците
Много от методите за получаване на белтъци показват и някои
техни свойства, т.е. могат да служат и за изследване. Например молекулна маса на
белтък може да се определи чрез ултрацентрофугиране, молекулно-ситова
хроматография или SDS-електрофореза. Тук ще бъдат споменати два метода, които са
само изследователски (а не препаративни) и дават огромно количество информация
за изследвания белтък. И в двата случая белтъкът трябва да бъде предварително
получен с извънредно висока чистота.
Установяване на първичната
структура (секвениране)
Подробното разглеждане на секвенирането излиза
извън рамките на нашия курс. Тук ще посочим само принципа.
Полипептидната верига се обработва с реактив, който се прикрепя към
N-крайната й аминокиселина (означен на рисунката с червен правоъгълник). След
това същият реактив предизвиква разкъсване на пептидната връзка между тази
аминокиселина и съседната. В разтвора се отделя крайната аминокиселина, свързана
с молекулата на реактива. Видът й се определя чрез хроматография и други методи
на аналитичната химия. От своя страна полипептидната верига се оказва скъсена с
един остатък – бившата втора аминокиселина сега е първа (N-крайна). Тя се
подлага на взаимодействие със същия реактив, откъсва се и се анализира. На ред
идва третата аминокиселина. Така една по една се разкриват всички аминокиселини
от веригата. Днес процесът е автоматизиран.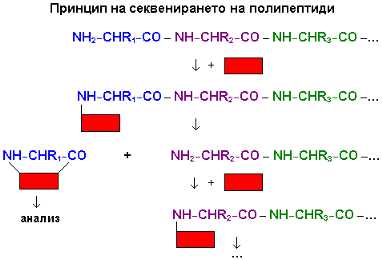
За пръв път
белтък е секвениран през 1954 г. от Ф. Сейнджър (Нобелова награда по химия за
1958). Това е инсулинът, съставен от 2 полипептидни вериги с общо 51
аминокиселинни остатъка.
Всъщност днес обикновено първичната структура
на даден полипептид се определя, като се секвенира не самият той, а генът му.
Като се знае последователността на нуклеотидите в гена, от нея може да се изведе
последователността на аминокиселините в съответната полипептидна верига. Този
начин изглежда излишно усложнен, но се предпочита, тъй като ДНК се секвенира
много по-лесно от белтъците. На въпроса ще се спрем по-подробно в раздела Генно
инженерство.
Установяване на пространствената структура чрез
рентгеноструктурен анализ
За да се разкрие пространствената структура на
даден белтък, той първо трябва да се пречисти и да се получи във вид на кристал.
Това, разбира се, съвсем не е естественото му състояние, но доколкото нативната
структура е термодинамично стабилна (т.е. най-бедна на свободна енергия),
обикновено тя не се променя съществено при кристализацията.
Кристалът се
подлага на рентгеноструктурен анализ – през него се пропуска сноп от рентгенови
лъчи. Те са много по-късовълнови не само от видимата светлина, а и от потоците
електрони в електронния микроскоп. Това позволява с тяхна помощ да се получи
информация за извънредно малки обекти като белтъчните молекули.
За
жалост рентгеновите лъчи не могат да се фокусират след преминаването им през
обекта, така че не можем пряко да получим образа му. За сметка на това може да
се получи дифракционната им картина и да се документира на рентгенограма. Тя се
състои от множество петна, чието разположение и интензивност показва структурата
на обекта.
Понеже не е образ на молекулата, рентгенограмата не говори
нищо на неспециалиста. Специалистите, владеещи рентгеноструктурния анализ, обаче
успяват от нея да получат информация за пространствената структура на белтъка и
да създадат модел на молекулата. Първият белтък, чиято пространствена структура
е разчетена, е миоглобинът. Кристал, рентгенограма и модел на белтък могат да се
видят на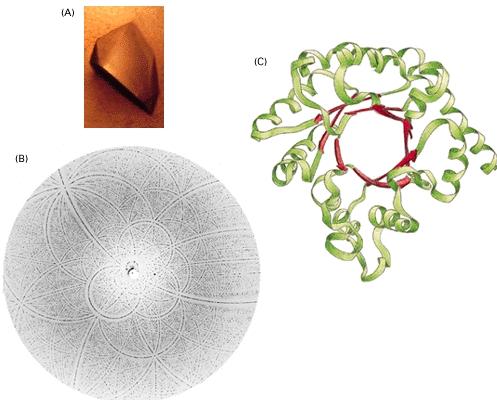

 Ако предлагате частни уроци, може да рекламирате услугите си напълно безплатно!
Ако предлагате частни уроци, може да рекламирате услугите си напълно безплатно!

Коментари